Wann kommt die IVDR?
Grundsätzlich startet der Geltungsbeginn der IVDR wie geplant am 26. Mai 2022.
Unter folgenden Bedingungen müssen Sie als Hersteller die Dokumentation für Ihr Produkt entsprechend der IVDR bis zum 26. Mai 2022 überarbeiten:
- Das Produkt trägt bereits eine CE-Kennzeichnung und für die Inverkehrbringung unter der IVDR ist die Beteiligung einer Benannten Stelle nicht erforderlich (z.B. Klasse A – nicht-steril).
- Es handelt sich um ein „neues“ Produkt unter der IVDR welches bisher keine CE-Kennzeichnung besitzt.
Wann kommt die IVDR für mein Produkt?
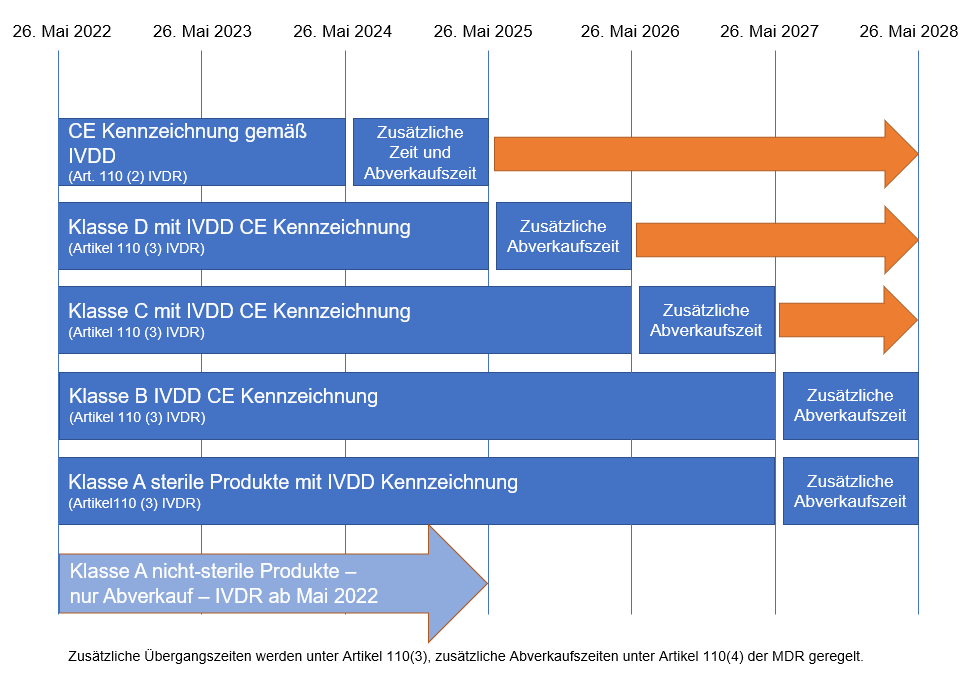
Die schrittweise Einführung ist für folgenden Produkte entsprechend der Risikoklasse (Klasse D „höchste“ zu Klasse A „niedrigste“) vorgesehen:
- Klasse D – z.B. HIV- oder Hepatitis Tests – 26. Mai 2025
Produkte die vor diesem Datum bereits in Verkehr gebracht wurden, dürfen bis zum Mai 2026 weiterhin auf dem Markt bereitgestellt oder in Betrieb genommen werden. - Klasse C – z.B. Virentests – 26. Mai 2026
Produkte die vor diesem Datum bereits in Verkehr gebracht wurden, dürfen bis zum Mai 2027 weiterhin auf dem Markt bereitgestellt oder in Betrieb genommen werden. - Klasse B und sterile IVDs Klasse A - 26. Mai 2027
Produkte die vor diesem Datum bereits in Verkehr gebracht wurden, dürfen bis zum Mai 2028 weiterhin auf dem Markt bereitgestellt oder in Betrieb genommen werden. - Klasse A nicht steril – 26. Mai 2022
Für Produkte der Klasse A (nicht steril) gibt es keine Übergangsfrist. Die IVDR ist voll umfänglich ab dem 26. Mai 2022 anzuwenden.
Wie lange darf ich mein Produkt noch verkaufen?
„Altprodukte“ die gemäß der Richtlinie 98/79/EG (IVDD) in Verkehr gebracht wurden, dürfen bis zum Mai 2025 auf dem Markt bereitgestellt (also abverkauft) oder in Betrieb genommen werden (Artikel 110(4)).
In der folgenden Abbildung haben wir die Timeline für Sie visualisiert.