Regulation (EU) 2017/746 on in vitro diagnostic medical devices (IVDR) - Alles Wissenswerte zur Verordnung über In-vitro-Diagnostika inkl. Amendment (Verordnung (EU) 2024/1860)
Inhalte, Timelines, Änderungen und NEUE Übergangsfristen kompakt zusammengefasst
+++ Das von der EU-Kommission erarbeitete Amendment (Verordnung (EU) 2024/1860) hat den langen bürokratischen Weg in Brüssel durchlaufen und ist mit der Veröffentlichung am 9. Juli 2024 im Europäischen Amtsblatt endlich in Kraft getreten. Die wesentlichen Änderungen und wie jetzt ganz konkret vorzugehen ist, erfährst du hier! +++
Die Verordnung (EU) 2017/746 über In-vitro-Diagnostika (IVDR)vom 5. April 2017 ist am 26. Mai 2022 in Kraft getreten. Die bis dahin gültige EU-Richtlinie für IVD, die Richtlinie 98/79/EG über In-vitro-Diagnostika (IVDD), wurde damit abgelöst und die IVDR bringt tiefgreifende Änderungen mit sich. Das heißt jedoch nicht, dass der regulatorische Schalter für Hersteller von IVD am 26. Mai 2022 vollständig umgelegt wurde. Die Änderungen sind komplex und auch bereits CE-gekennzeichnete IVD sind nach den Anforderungen der IVDR neu zu zertifizieren. Die neue EU-Verordnung führt für viele Produkte zu höheren Anforderungen.Um das System nicht zum Kollabieren zu bringen, geschieht die Umsetzung der EU-Verordnung schrittweise unter Einbindung von Übergansfristen. Die wesentlichen Änderungen zusammengefasst:
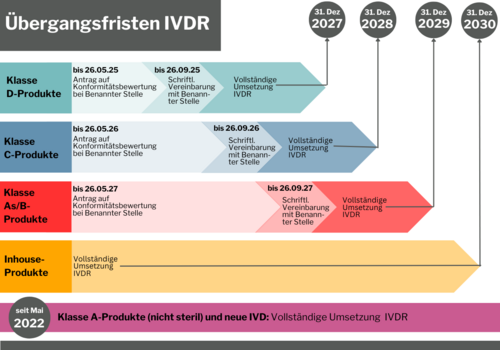
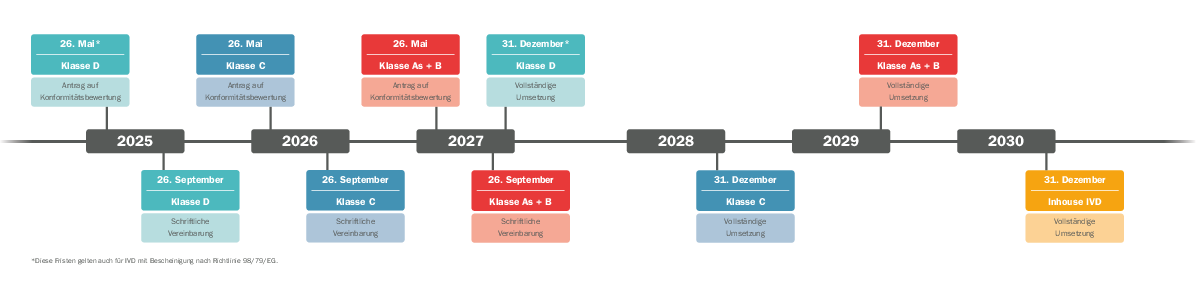
- Neue Übergangsfristen
- Aktuelle Timeline für die Zusammenarbeit mit Benannten Stellen
- To-Do-Liste für IVD Hersteller zum Download
- Risikoklassen
- Benannte Stellen
- Verantwortliche Person (PRRC)
- Unique Device Identification (UDI)
- Technische Dokumentation und Leistungsstudien
- Konformitätsbewertungsverfahren
- Grundlegende Sicherheits- und Leistungsanforderungen (GSPR)
IVDR Übergangsfristen: Verlängerung vom Europäischen Parlament bestätigt
Am 25. April 2024 hat das EU-Parlament die Vorschläge der Europäischen Kommission zur Sicherstellung der Verfügbarkeit von In-vitro-Diagnostika bestätigt. Hersteller haben nun mehr Zeit, die Inhalte umzusetzen. Anders als bisher, sehen die aktuellen Übergangsbestimmungen einen festen Zeitplan für die Einbindung der Benannten Stelle, jeweils abhängig von der Risikoklasse, vor. Mit der Veröffentlichung im Europäischen Amtsblatt am 9. Juli 2024 sind die neuen Fristen endlich verbindlich und der sich androhende Engpass in der medinizinischen Versorgung scheint zunächst abgewendet.
Die Risikoklasse ist entscheidend
Welche Übergangsfrist kommt zum Tragen? Welche Sonderfälle gibt es? Im Prinzip ist zu sagen, dass steigendes Risiko auch weiterhin zu sinkenden Fristen führt - außer für nicht sterile Klasse A-Produkte. Für diese Produktklasse wird gemäß IVDR nach Konformitätsbewertung ohne Benannte Stelle eine Konformitätserklärung durch den Hersteller abgegeben, die in Folge zur CE-Kennzeichnung führt. Seit Inkrafttreten der IVDR am 26. Mai 2022 wird bereits so verfahren.
Sonderfall gültige IVDD CE-Kennzeichnung
Produkte mit gültiger IVDD CE-Kennzeichnung, für die keine CE-Kennzeichnung nach IVDR angestrebt wird, dürfen weiter Inverkehr gebracht werden, sofern eine Benannte Stelle bei der IVDD CE-Kennzeichnung involviert war und eine angemessene Überwachung durch diese, oder nach Übereinkunft mit einer nach IVDR Benannten Stelle, sichergestellt ist. Mit Ablauf der IVDD-Bescheiningung endet diese Möglichkeit jedoch.
Qualitätsmanagementsystem bis 26. Mai 2025
Anforderungen bezüglich der Überwachung nach dem Inverkehrbringen (Post-Market-Surveillance), der Marktüberwachung, die Vigilanz und die Registrierung von Wirtschaftsakteuren der Produkte müssen umgehend gemäß IVDR umgesetzt werden und die Anpassung des Qualitätsmanagementsystems auf Basis der IVDR-harmonisierten EN ISO 13485:2016 hat bis zum 26. Mai 2025 stattzufinden.
Aktuelle Timeline für alle IVD Risikoklassen
To-Do-Liste für IVD-Hersteller
Das Wesentliche nicht aus den Augen verlieren. Unser RA-Team hat eine To-Do-Liste mit der korrekten Vorgehensweise für einen gelungenen Übergang von IVDD zur IVDR zusammengestellt. Von der richtigen Risikoklasse über die Konformitätsbewertung bis hin zur UDI, das richtige Vorgehen zur richtigen Zeit. Nutze unsere To-Do-Liste und gestalte einen erfolgreichen Übergang zur IVDR, an dessen Ende die rechtskonforme CE-Kennzeichnung steht.
Du brauchst Unterstützung?
Unsere IVDR-ExpertenInnen helfen weiter!
Download
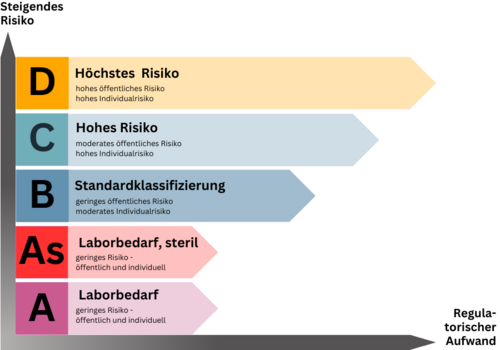
Einteilung der IVDR Risikoklassen
Die Klassifizierung sieht eine regelbasierte Einteilung in Risikoklassen von A/A steril (As) bis D bzw. geringem bis hohem Risiko vor. Eine vorab festgelegte Liste nach Klassen und Produkten gibt es leider nicht, sodass die Klassifizierung durch den Hersteller auf Basis des Regelwerkes zu erfolgen hat. Vom Hersteller falsch klassifizierte Produkte führen zu Abweichungen im Audit oder bei der Produktprüfung durch die Benannte Stelle, was den Zulassungsprozess und die Markteinführung empfindlich verzögern könnte.
Ohne Benannte Stelle geht (fast) nichts mehr
Über kurz oder lang ist nach Ablauf der Übergangsfristen für alle Produkte der Klassen A steril (As), B, C und D das Mitwirken einer Benannten Stelle für den Zulassungsprozess nach IVDR erforderlich. Lediglich nicht sterile Klasse A-Produkte sind davon ausgenommen. Die grundsätzliche Einbindung Benannter Stellen unter IVDR führt zu einem ungleich höheren Bedarf an Benannten Stellen als noch unter IVDD. Darüber hinaus wächst der Anspruch an die Benannten Stellen selbst, sodass Angebot und Nachfrage in ein erhebliches Ungleichgewicht rutschen könnten.
Verantwortliche Person zwingendes Muss – Person Responsible for Regulatory Compliance (PRRC)
Der Artikel 15 der IVDR sieht den Einsatz einer solchen verantwortlichen Person vor, daher wird in dem Zusammenhang auch häufig von einer Artikel-15-Person gesprochen. Im Konkreten heißt das, dass die Hersteller mindestens eine Person im Unternehmen benennen müssen, die für Einhaltung und Umsetzung der Regulierungsvorschriften verantwortlich ist. Der naheliegende Gedanke, dass die PRRC der neue Name für die Sicherheitsbeauftragten ist, ist nicht zutreffend. Verantwortung und Befugnisse gehen weit über die bisherigen hinaus. Die Qualifikation der Person Responsible for Regulatory Compliance (PRRC) ist zwingend nachzuweisen und darüber hinaus ist die Registrierung in der EUDAMED und im Actor Registration Module verpflichtend. Zusätzlich ist eine freiwillige Registrierung im Deutsches Medizinprodukte-Informations- und Datenbanksystem (DMIDS) möglich. Neben Artikel 15 bietet die MDCG 2019-7_Rev.1 detailliertere Informationen bezüglich der erforderlichen Qualifikationen sowie der Aufgaben des PRRC.
Unique Device Identification (UDI)
Die schon aus MDR bekannte UDI, die einmalige Produktkennung bestehend aus einem numerischen oder alphanumerischen Code, die sich aus jeweils einmaligen Produkt- und Herstellungskennungen (Device Identifier = UDI-DI, Production Identifier = UDI-PI) zusammensetzt, ist nach IVDR für alle IVD verpflichtend. Die UDI ermöglicht effizientere Rückverfolgbarkeit sowie vereinfachte Rückrufe der Produkte. Die Fälschung von Medizinprodukten wird erschwert und die Patientensicherheit erhöht. Weitere Informationen zur UDI
Technische Dokumentation praktisch nicht ohne Leistungsstudie möglich
Die Leistungsanforderungen an die Technische Dokumentation ist erheblich gestiegen sowohl im Inhalt als auch im Umfang. Leistungsstudien sind gemäß IVDR erforderlich zur Feststellung oder Bestätigung der Analyseleistung und der klinischen Leistung eines Produktes. Die Hersteller haben im Rahmen der Technischen Dokumentation Nachweise zu bringen, dass die Risikoklasse der Art und der Sicherheit des Produktes entspricht.
Du brauchst Unterstüzung bei der Technischen Dokumentation? Unsere ExpertenInnen helfen weiter!
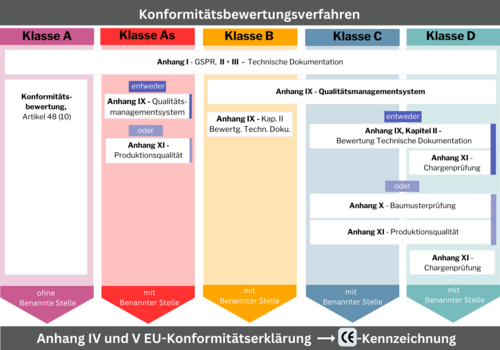
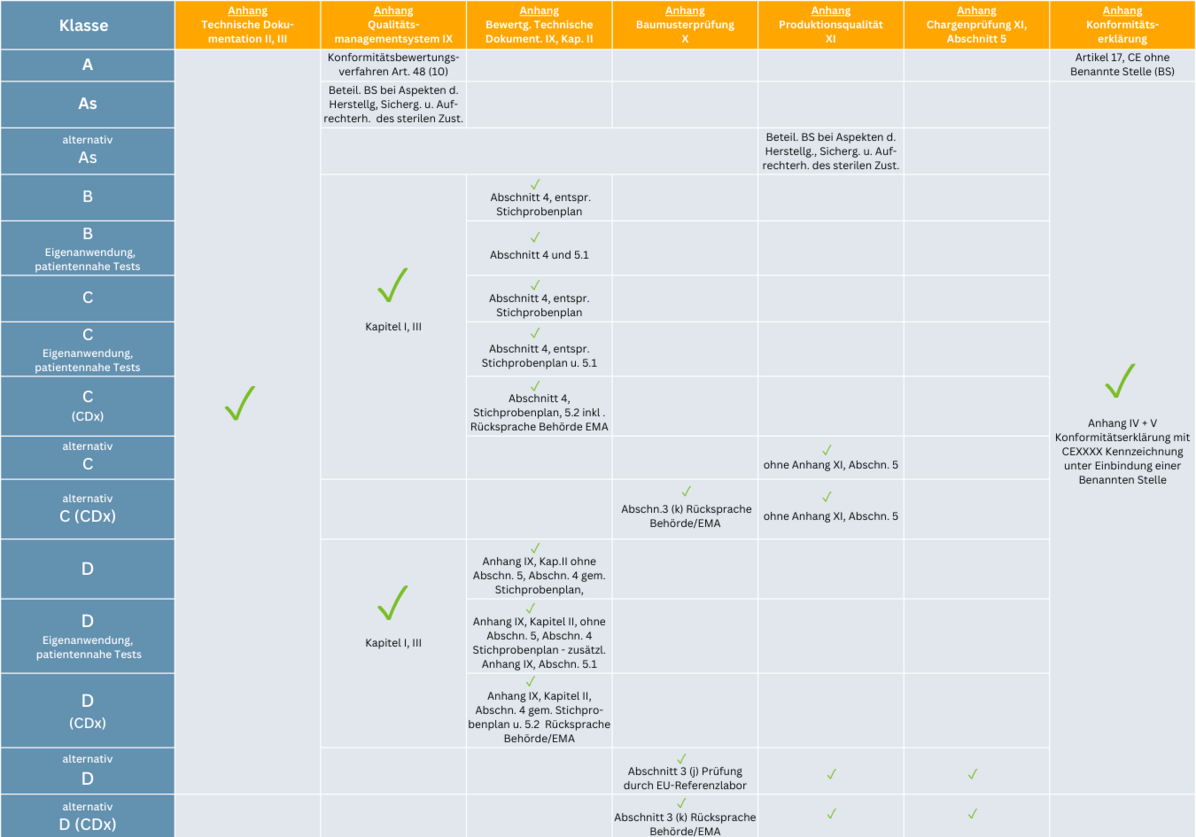
Konformitätsbewertungsverfahren mit Benannter Stelle
Die Konformitätsbewertungsverfahren sind von der Risikoklasse abhängig und bei einer Benannten Stelle zu beantragen. Nichtsterile Klasse A-Produkte sind davon befreit. Es reicht eine Konformitätserklärung ohne Einbindung einer Benannten Stelle. Für alle weiteren Risikoklassen regeln die Anhänge I, II, III, IX, X und XI der IVDR die Konformitätsbewertungsverfahren. Auch hier steigt der Anspruch mit dem Risiko.
Risikoklasse As, B, C, D
- Anhang I – Grundlegende Sicherheits- und Leistungsanforderungen
- Anhang II – Technische Dokumentation
- Anhang III – Technische Dokumentation über die Überwachung nach dem Inverkehrbringen/Postmarket Suveillance
- Anhang IX – Qualitätsmanagementsystem
Risikoklasse C, D
- Anhang X – EU-Baumusterprüfung
- Anhang XI – Produktionsqualitätssicherung
- Anhang XI – Produktchargenprüfung
Nachweise zu den Grundlegende Sicherheits- und Leistungsanforderungen/ General Safety And Performance Requirements (GSPR)
Der Anhang I der IVDR regelt den Umgang mit den GSPR. Im Rahmen des Konformitätsbewertungsverfahren haben die Hersteller den Nachweis der Erfüllung der Grundlegenden Sicherheits- und Leistungsanforderungen zu erbringen u.a.:
- Risikomanagement, das ein vertretbares Nutzen-Risikoverhältnis gewährleistet
- Einhaltung der relevanten Normen (State of the Art)
- Leistungsbewertung
- Funktionale Sicherheit
- Biologische Sicherheit
- IT-Sicherheit (Cybersecurity)
- Software-Lebenszyklus-Prozesse einschließlich Verifizierung und Validierung
- Gebrauchsanweisungen etc.
Die dafür relevante Prüfnorm ist die IEC 61010-1 inklusive des dazugehörigem Particular Standard 61010-2-101. Der Nachweis dieser grundlegenden Anforderungen der IVDR durch ein akkreditiertes Prüflabor führt zwangsläufig zu einem widerspruchsfreien Ergebnis und damit zur Akzeptanz bei Benannten Stellen. Das KEYMKR Prüflabor ist für die im Rahmen der IVDR relevanten Sicherheitsprüfungen akkreditiert.
Technische Dokumentation und akkreditierte Prüfung - bei KEYMKR alles aus einer Hand. Das können nur wir!
IEC 61010-1
Sicherheitsbestimmungen für elektrische Mess-, Steuer-, Regel- und Laborgeräte - Teil 1: Allgemeine Anforderungen
IEC 61010-2-101
Sicherheitsbestimmungen für elektrische Mess-, Steuer-, Regel- und Laborgeräte- Teil 2-101: Besondere Anforderungen an In-Vitro-Diagnostik Medizingeräte