Mit der Unique Device Identification (UDI) regelt die IVDR die eindeutige Produktkennung
Warum hat die die EU-Kommission das UDI-System eingeführt?
Die Einführung der UDI im Rahmen der In-Vitro Diagnostic Device Regulation (IVDR) 2017/746 wird in Anhang II Teil C geregelt und hat verschiedene Zielsetzungen:
- Die Rückverfolgbarkeit der Medizinprodukte ist so leichter möglich
- Effektivere Post Market Surveillance (PMS) Aktivitäten
- Verbesserung des Monitorings durch die zuständigen Behörden
- Reduzierung medizinischer Fehler
- Stringenteres Vorgehen gegen Plagiate
- Verbesserung der Einkaufs- und Entsorgungsrichtlinien
- Gesundheitseinrichtungen sowie weiteren Wirtschaftsakteuren ist effektivere Bestandsverwaltung möglich
Was unterscheidet die Basis-UDI-DI von der UDI-DI?
Basis-UDI-DI (Family Identifier) - Primäre Produktkennzeichnung
Basis-UDI-DI kennzeichnet ein Produktmodell oder eine gesamte Produktfamilie. Sie erscheint
- in der EUDAMED Datenbank und in offiziellen Dokumenten
- nie auf den Produkten oder deren Verpackungen
UDI-DI (Child Identifier)
- erscheint in der EUDAMED-Datenbank
- erscheint auf den Produkten und/oder deren Verpackungen
Was ist die Basis-UDI-DI?
Primäre Produktkennzeichnung oder Family Identifier
Die Basis-UDI-DI kennzeichnet ein Produktmodell oder eine gesamte Produktfamilie. Sie erscheint niemals auf den Produkten selber oder deren Verpackungen sondern in der EUDAMED-Datenbank sowie folgenden Dokumenten:
- Vigilanz und Post Market Surveillance Reports (wie MIR und PSUR)
- EU-Konformitätserklärung (Anhang IV MDR/IVDR)
- Technische Dokumentation (Anhang II MDR/IVDR)
- Kurzbericht über Sicherheit und klinische Leistung (Artikel 32(2) MDR, Artikel 29(2) IVDR)
- Freiverkaufszertifikate (Artikel 60 MDR, Artikel 55 IVDR)
- Bestimmte Arten von EU-Bescheinigungen, d.h. Konformitätsbewertung auf der Grundlage eines QM-Systems und einer Bewertung der Technischen Dokumentation (Anhang IX MDR/IVDR), EU Baumusterprüfbescheinigung (Anhang X MDR/IVDR) und Konformitätsbewertung auf der Grundlage einer Produktkonformitätsprüfung (Anhang XI MDR/IVDR)
- Implantationsausweisen (nur MDR Artikel 18)
Was ist die UDI-DI?
Der Device Identifier
- einmaliger numerischer oder alphanumerischer Code
- einem Produktmodel zugehörig
- Zugangsschlüssel zu den Informationender UDI-Datenbank
- für Menschen lesbar - Human Readable Interpretation "HRI"
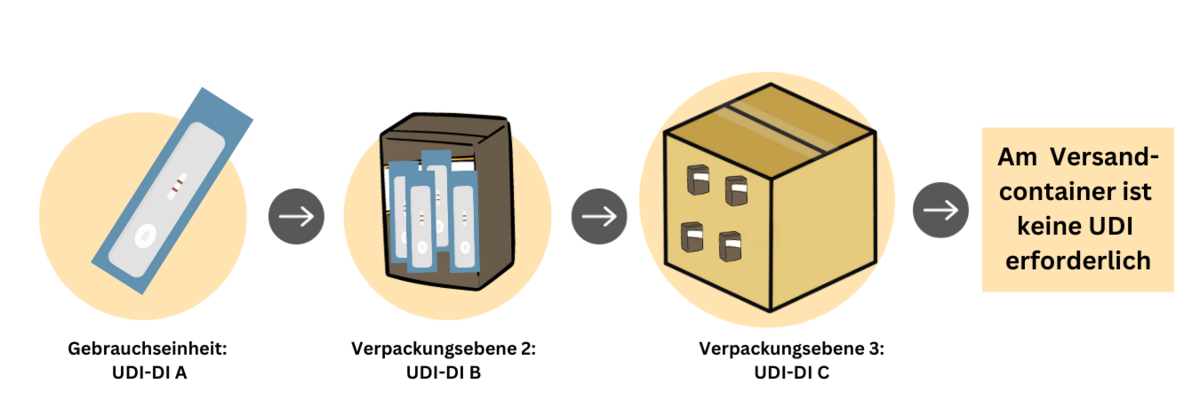
- höhere Verpackungsebenen verfügen über eine eigene UDI
- jede Ebene der Produktverpackungen hat eine eigene, einmalige UDI-DI
Was ist die die UDI-PI
Der Productidentifier
Die UDI-PI ist ein numerischer oder alphanumerischer Code, der die Produktionseinheit des Produktes kennzeichnet. Zu den verschiedenen Arten der UDI-PI gehören die:
- Seriennummer
- Losnummer
- Sofware-Identifikation
- Herstellungs- oder Verfallsdatum oder beide Daten
Aufbau und Bedeutung des Unique Identifiers