EU Kommission hat progressiven Roll-out der IVDR 2017/746 bekanntgegeben
Im Rahmen der Regulation (EU) 2022/112 wurden ebenfalls Anpassungen für hausintern in Gesundheitseinrichtungen hergestellte Produkte vorgenommen.
Was muss ich beachten, wenn mein Produkt in einer Gesundheitseinrichtung hergestellt wird?
Sollte Ihr Produkt entsprechend des Artikels 5(5) der IVDR hausintern in einer Gesundheitseinrichtung hergestellt und in genau dieser Gesundheitseinrichtung genutzt werden, können Sie ebenfalls von den Übergangsfristen profitieren.
Was geschieht ab dem 26. Mai 2022?
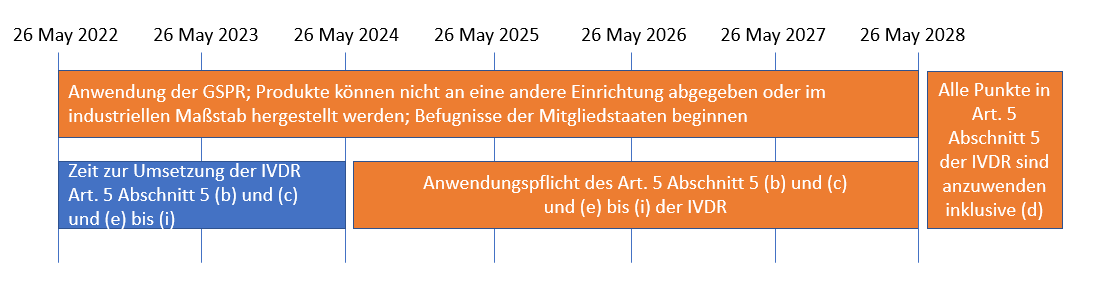
- Mit dem Datum des Geltungsbeginns der IVDR (26. Mai 2022) muss Ihr Produkt die grundlegenden Sicherheits- und Leistungsanforderungen (GSPR) erfüllen.
- Ihr Produkt darf nur innerhalb Ihrer Einrichtung genutzt und nicht an eine andere Einrichtung abgegeben werden oder im industriellen Maßstab gefertigt werden.
- Die Durchsetzungsbefugnisse der Mitgliedsstaaten für Gesundheitseinrichtungen beginnen, damit erhalten diese die richtigen Instrumente zur Ahndung von Verstößen.
Was kommt später auf mich zu?
Ab dem 26. Mai 2024 müssen Sie als Gesundheitseinrichtung die Anforderungen des Artikels 5 Abschnitt 5 (b), (c), (e) bis (i) erfüllen. Das heißt, dass Sie folgende Punkte bis zum Mai 2024 umsetzen müssen. Eine freiwillige Umsetzung kann natürlich bereits vorher erfolgen:
b) Herstellung und Verwendung des Produktes im Rahmen geeigneter Qualitätsmanagementsysteme
c) Das Labor der Gesundheitseinrichtung entspricht der Norm EN ISO 15189 oder ggf. nationalen Vorschriften/Akkreditierungsvorschriften
e) Auf Ersuchen der zuständigen Behörde stellen Sie Informationen über die Verwendung der betreffenden Produkte zur Verfügung inklusive Begründung für deren Herstellung, Änderung und Verwendung.
f) Sie verfassen eine öffentlich zugängliche Erklärung mit folgendem Inhalt:
i) Name und Anschrift der Gesundheitseinrichtung, die die Produkte herstellt
ii) Zur Identifizierung der Produkte erforderlichen Angaben
iii) eine Erklärung, dass die Produkte die GSPRs gemäß Anhang I der IVDR erfüllen, und ggf. Angaben – mit entsprechender Begründung – darüber, welche Anforderungen nicht vollständig erfüllt sind.
g) Für Produkte, die in die Klasse D eingestuft werden, sind Unterlagen zu erstellen, die ein Verständnis der Herstellungsstätte, des Herstellungsverfahrens, der Auslegung und der Leistungsdaten der Produkte einschließlich ihrer Zweckbestimmung ermöglichen. Hier wird ein Detailgrad erwartet, mit dem die zuständige Behörde sich vergewissern kann, dass die GSPRs gemäß Anhang I der IVDR erfüllt sind. Es ist möglich, dass unterschiedliche Mitgliedsstaaten diese Punkte auch auf Produkte der Klassen A, B oder C anwenden.
h) Sie ergreifen Maßnahmen, um sicherzustellen, dass sämtliche Produkte in Übereinstimmung mit den in g genannten Unterlagen hergestellt werden.
i) Sie begutachten die Erfahrungen, die aus der klinischen Verwendung der Produkte gewonnen wurden und ergreifen alle erforderlichen Korrekturmaßnahmen.
Ab dem 26. Mai 2028 muss auch Artikel 5 Abschnitt 5 (d) erfüllt sein, d.h., dass Sie in Ihrer Dokumentation eine Begründung dafür liefern, dass spezifische Erfordernisse der Patientengruppe auf entsprechendem Leistungsniveau nicht durch ein gleichartiges auf dem Markt befindliches Produkt erfüllt werden können.
In der folgenden Abbildung haben wir die Timeline für Sie visualisiert.