Wozu brauchen wir die EUDAMED Datenbank und ist die wirklich wichtig?
Im Artikel 33 der MDR sowie Artikel 30 der IVDR wird die Errichtung und Pflege einer Europäischen Datenbank für Medizinprodukte (EUDAMED) gefordert. Die Anzahl der EUDAMED Nennungen und Verweise innerhalb dieser Regulationen gibt erste Hinweise auf die Wichtigkeit der Datenbank. Die Ziele von EUDAMED sind u.a. die Transparenz und die Koordination von Informationen zu Medizinprodukten innerhalb des europäischen Marktes zu erhöhen.
Die European Medical Device Coordinating Group (MDCG) hat in der MDCG 2020-15 angekündigt, dass alle Wirtschaftsakteure sich ab dem 01.12.2020 in EUDAMED registrieren können und auf diesem Weg eine Single Registration Number (SRN) erhalten. Die SRN wird künftig bei Konformitätserklärung und Zertifikaten anzugeben sein, was die Wichtigkeit der Registrierung in EUDAMED unterstreicht.
Außerdem hat die MDCG die Guidances MDCG 2019-4 bezüglich der Timelines zur Registrierung der Medizinprodukte sowie die MDCG 2019-5 zur Registrierung von Legacy Devices in EUDAMED veröffentlicht.
Wann kann ich EUDAMED nutzen?
EUDAMED besteht aus sechs Modulen und wird in drei Schritten freigeschaltet:
- Registrierung von Wirtschaftsakteuren (01. Dezember 2020)
- UDI und Registrierung der Medizinprodukte (Mai 2021)
- Benannte Stellen und Zertifikate (Mai 2021)
- Vigilanz (Termin offen)
- Klinische Prüfungen und Leistungsstudien (IVD) (Termin offen)
- Marktüberwachung nach dem Inverkehrbringen (Termin offen)
Die volle Funktionsfähigkeit von EUDAMED wird im Mai 2022 erwartet.
Wer sind die Wirtschaftsakteure?
Wie bereits erwähnt ist EUDAMED seit dem 01.12.2020 zur Registrierung der Wirtschaftsakteure freigeschaltet.
Zu den Wirtschaftsakteuren zählen:
- Hersteller (Manufacturer [MF])
- Bevollmächtigter (Authorised representative [AR])
- Hersteller von System- und Behandlungseinheiten (System & procedure pack producer [PR])
- Importeur (IM)
Händler werden in EUDAMED nicht registriert.
Auch Sponsoren, als Verantwortliche für klinische Prüfungen, werden nicht als Wirtschaftsakteure definiert. Zur eindeutigen Identifizierung erhalten diese eine ID und keine SRN. Hierbei handelt es sich lediglich um einen formellen aber nicht um einen praktischen Unterschied zwischen der ID und der SRN.
Die unterschiedlichen Rollen der Wirtschaftsakteure sind für alle Interessierten auch in der einer Grafik der Europäischen Kommission dargestellt.
Wie funktioniert die Registrierung in EUDAMED?
Bis zur vollen Funktionsfähigkeit ist die Nutzung von EUDAMED freiwillig. Die frühzeitige Registrierung wird trotz der Freiwilligkeit dringend empfohlen, da sie auch zu einem früheren Zeitpunkt Vorteile mit sich bringt. Zum Beispiel kann es die Notwendigkeit einer Neuausstellung behördliche Unterlagen, für die die Single Registration Number (SRN) erforderlich ist minimieren. Parallel zur Registrierung der Wirtschaftsakteure ist die einheitliche Verwendung der SRN wie in der MDR vorgegeben möglich (z.B. SRN auf Zertifikaten). Auch aufgrund des zu erwartenden Workloads (auch bei den zuständigen Behörden) empfiehlt sich eine frühzeitige Registrierung der Wirtschaftsakteure.
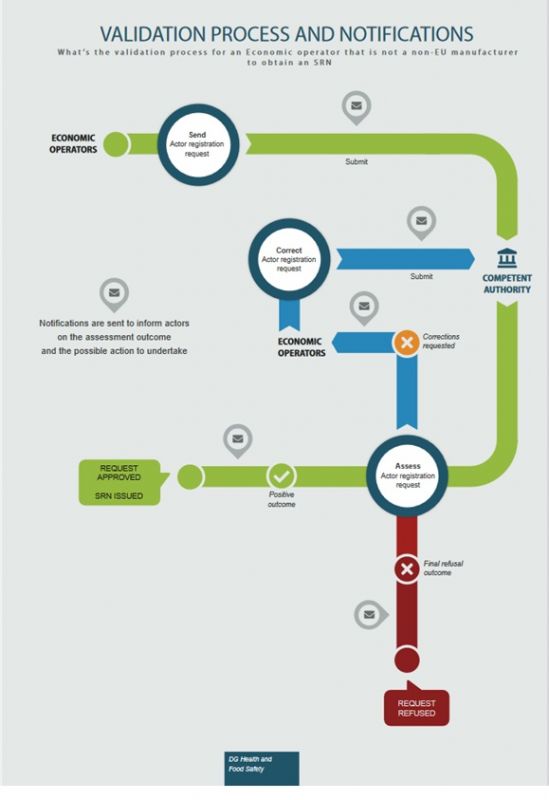
Um eine SRN zu erhalten stellt der Wirtschaftsakteur einen Antrag bei der zuständigen nationalen Behörde. Diese prüft die Anfrage und vergibt bei positiver Bewertung eine SRN welche in EUDAMED generiert und and den anfragenden Wirtschaftsakteur übermittelt wird. Jeder Wirtschaftsakteur muss mit seinem Registrationsantrag auch eine „Declaration on information security responsibilities“ vorlegen:
Wirtschaftsakteure außerhalb der EU stellen ebenfalls einen Registrierungsantrag, der durch ihren Bevollmächtigten bestätigt werden muss. Erst danach wird diese Anfrage an die zuständige nationale Behörde weitergeleitet. EUDAMED informiert die Hersteller außerhalb der EU über die Erzeugung einer SRN. Zur EUDAMED Registrierung muss in diesem Fall zusätzlich ein „Mandate Summary document“ vorgelegt werden:
Im Folgenden sehen Sie die Infografik zum Registrierungsprozess der EU Wirtschaftsakteure: